ページの本文です。
クリアランスによる脳卒中後の損傷拡大の抑制 -脳内の水の動きが鍵-
2019年5月20日更新
お茶の水女子大学基幹研究院自然科学系の毛内拡助教(理化学研究所(理研)脳神経科学研究センター神経グリア回路研究チーム客員研究員)、平瀬肇チームリーダー、慶應義塾大学医学部の安井正人教授らの国際共同研究グループ※は、マウスを用いた研究から、脳内のカリウムイオン(K+)の排出(クリアランス)機構を促進することにより、虚血[1]後の脳損傷を軽減する仕組みを解明しました。
本研究成果は、さまざまな脳血管障害に共通して生じる組織損傷のメカニズムの解明とその治療法の開発に貢献すると期待できます。
脳卒中[2]や外傷性脳損傷などの脳血管障害では、多くの場合、障害発生部位だけでなく健康な部位にまで損傷が拡大します。この損傷拡大には、主に脳内の細胞外のK+濃度の急上昇が引き金となることが知られています。
今回、国際共同研究グループは、ノルアドレナリン[3]と呼ばれる神経伝達物質の受容体(アドレナリン受容体)を阻害すると、脳梗塞[2]後の神経保護と脳機能回復の効果があることを見いだしました。そして、脳内の水の動きを調べた結果、アドレナリン受容体の阻害によって、「アクアポリン4[4]」と呼ばれる水分子の透過を担う膜タンパク質のアストロサイト[5]における局在が確保され、K+濃度の正常化が促進されることを見いだしました。
本研究は、米国の科学雑誌『Proceedings of the National Academy of Sciences (PNAS)』のオンライン版(5月13日付け:日本時間5月14日)に掲載されました。
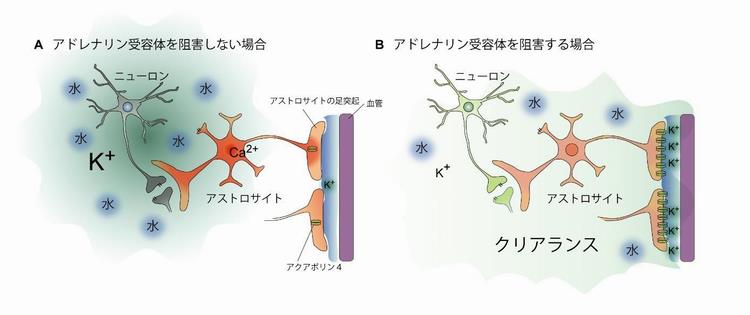
図 アドレナリン受容体の阻害によってK+を正常化する排出(クリアランス)のモデル
※国際共同研究グループ
| お茶の水女子大学 基幹研究院自然科学系 | ||
|---|---|---|
| 助教 | 毛内 拡 | (もうない ひろむ) |
| (理化学研究所 脳神経科学研究センター 神経グリア回路研究チーム 客員研究員) | ||
| 理化学研究所 脳神経科学研究センター 神経グリア回路研究チーム | ||
| テクニカル・スタッフII | 王 筱文 | (ワン シャオウェン) |
| テクニカル・スタッフI | 矢作 和子 | (やはぎ かずこ) |
| 研究員 | 岩井 陽一 | (いわい よういち) |
| チームリーダー | 平瀬 肇 | (ひらせ はじめ) |
| (University of Copenhagen Center for Translational Neuromedicine, 教授) | ||
| 慶應義塾大学 医学部 | ||
| 専任講師 | 阿部 陽一郎 | (あべ よういちろう) |
| 教授 | 安井 正人 | (やすい まさと) |
| University of Rochester Medical Center | ||
| 研究員 | ナンホン・ロウ | (Nanhong Lou) |
| 研究員 | フンベルト・メストレ | (Humberto Mestre) |
| 研究員 | キウ・シュ | (Qiwu Xu) |
| 教授 | マイケン・ネーダーガード | (Maiken Nedergaard) |
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金若手研究「脳のクリアランス促進による恒常性維持機構の解明(研究代表者:毛内拡)」、基盤研究A「グリア細胞により支援される皮質神経回路の可塑性(研究代表者:平瀬肇)」、新学術領域「グリアアセンブリによる脳機能発現の制御と病態(領域代表者:池中一裕)」の「生体内で起こる皮質回路シナプス可塑性におけるアストロサイトの役割(研究代表者:平瀬肇)」、新学術領域「脳情報動態を規定する多領野連関と並列処理(領域代表者:尾藤晴彦)」の「神経修飾物質による皮質アストロサイトの中長期的な活動観測と機能的意義の解明(研究代表者:平瀬肇)」、ヒューマン・フロンティア・サイエンス(研究代表者:平瀬肇)、平成30年度研究拠点形成事業(A先端拠点形成型)「階層横断的グリア脳科学研究のための国際コンソーシアム拠点形成(拠点代表者:和氣弘明)」、挑戦的研究(萌芽)「アクアポリン4機能と脳リンパ排泄機構に着目したアルツハイマー病発症機構の解明(研究代表者:阿部陽一郎)」、基盤研究B「視神経脊髄炎の動物モデルと抗アクアポリン4抗体を用いた新規治療法の開発基盤研究(研究代表者:阿部陽一郎)」、基盤研究B「脳浮腫の新規治療法開発:アクアポリン4の調節機構と創薬基盤研究(研究代表者:安井正人)」、基盤研究B「脳リンパ流の生理とその破綻による高次脳機能低下メカニズムの解明(研究代表者:安井正人)」、Adelson医学研究財団(研究代表者:マイケン・ネーダーガード)米国国防総省(研究代表者マイケン:ネーダーガード)による支援を受けて行われました。
1.背景
脳卒中や外傷性脳損傷などの脳血管障害では、多くの場合、障害発生部位のみならず健康な部位にまで損傷が拡大してしまう二次的損傷が起こります。この二次的損傷によって、うつ病や言語・認知・運動機能障害などの後遺症が生じ、長期にわたる日常生活の質の低下およびリハビリや介護の必要性から、社会的・経済的な損失が問題となっています。
損傷拡大には、脳血管障害の最初期(超急性期)に繰り返し生じる異常な神経興奮の波の伝播(拡延性脱分極)が関与しています。拡延性脱分極の発生には、主に脳内のカリウムイオン(K+)濃度の急上昇が引き金となります。脳血管障害の一種である虚血性脳卒中では、脳血管が詰まること(梗塞)によって生じる虚血が組織の壊死を引き起こします。現在利用されている脳梗塞の治療法は、血栓溶解剤や脳保護薬などの対処療法であり、細胞外K+濃度の正常化を標的とした具体的な治療法の開発が喫緊の課題となっていました。
脳は、頭蓋骨の中で脳脊髄液[6]と呼ばれる液体に浸っています。脳脊髄液は、ナトリウムイオン(Na+)やK+をはじめとするさまざまなイオンが含まれており、健常状態にある脳では各イオン濃度は一定に保たれています。脳脊髄液は頭蓋内を循環し、その動態が脳機能の恒常性に重要な役割を果たしていると考えられますが、その詳細は完全には解明されていません。
平瀬チームリーダーらは、これまで脳脊髄液の動態に、水分子の動態が関与することに着目して研究を進めてきました。2018年には、脳脊髄液を脳組織内へ浸潤させる機序に、水分子の透過を担う「アクアポリン4」という膜タンパク質(チャネル分子)が関与する検証実験を行いました注1)。
また脳脊髄液の動態に、神経伝達物質のノルアドレナリンが関与している可能性があります。これまで、ノルアドレナリンの受容体(アドレナリン受容体)を阻害することによって、脳脊髄液の浸潤が促進されることが報告されています注2)。さらに脳梗塞の直後、脳のノルアドレナリン濃度が急激に増加することが知られています。これまで、脳梗塞の超急性期においてアドレナリン受容体に着目した研究結果は断片的に報告されていますが、統一的な見解は得られていませんでした。
そこで、国際共同研究グループは、アドレナリン受容体を阻害することで、脳脊髄液の浸潤を促進し、脳梗塞後の細胞外K+濃度の正常化を図れると予想しました。
注1) Mestre et al. eLife 2018;7:e40070 doi: 10.7554/eLife.40070
注2) Xie et al. Science 2013;342(6):373-377 doi: 10.1126/science.1241224
2.研究手法と成果
国際共同研究グループはまず、レーザーを用いた光血栓法[7]によって、大脳皮質に局所的に脳梗塞を生じる脳梗塞モデルマウスを作製し、アドレナリン受容体の阻害薬の効果を調べました。24時間後に脳の損傷を評価するTTC染色を行った結果、アドレナリン受容体の阻害薬を投与しないマウスでは、レーザーを照射した面積よりも損傷部位が広がっていました。一方、マウスにアドレナリン受容体の阻害薬をあらかじめ投与した場合は、損傷を最小限に食い止められることを見いだしました(図1)。また、脳梗塞発生から2時間以内であれば、事後投与も有効であることが分かりました。さらに、ヒトの脳梗塞に近いモデルとして用いられる、中大脳動脈閉塞・再灌流による脳梗塞モデルマウスでも同様の結果が得られました。
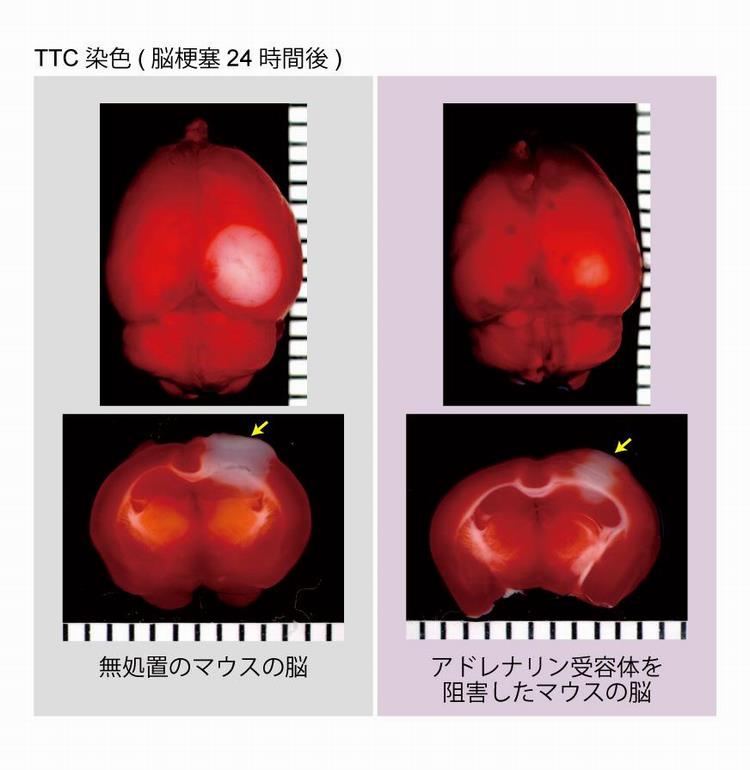
図1 脳梗塞24時間後の脳損傷部位の大きさの評価
右側大脳皮質の感覚野に脳梗塞を起こしてから24時間後に脳を摘出し、TTC染色を行った。この染色法では、脳細胞が生きていれば赤く染まり、壊死した部位では白いままとなる。
(左)無処置のマウスの脳。上下の図はそれぞれ、大脳皮質表面と上の脳を1mm間隔で冠状断(脳を前後に分ける面)で輪切りにしたうちの1枚。いずれも右脳に壊死した白い部位(矢印)が見られる。
(右)アドレナリン受容体の阻害薬を事前に投与したマウスの脳。左の図に比べて、壊死した白い部位(矢印)が少ないことが分かる。
また、右側大脳皮質に梗塞をおこしたマウスを透明な円柱の中で自由に行動させ、つかまり立ちをする際に使用する前肢の使用パターンを観察しました(シリンダー試験)。その結果、マウスは脳梗塞後2日間にわたって、左側皮質が支配する右前肢を使用する頻度が上昇しました。一方、アドレナリン受容体の阻害薬を事前に投与したマウスでは、左右の前肢の使用頻度に差は見られませんでした(図2)。これにより、アドレナリン受容体の阻害薬の事前投与は、行動試験による運動機能の回復にも有効であることが分かりました。
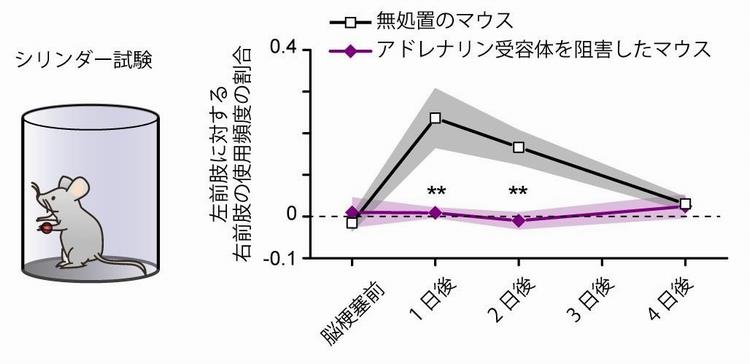
図2 シリンダー試験によるマウスの運動機能の評価
脳梗塞を起こしたマウスを透明な円柱の中で自由に行動させ、つかまり立ちをする際に使用する前肢の使用頻度に差があるかどうかを調べた。左右に偏りがない場合、グラフは0になり、縦軸がプラスになるほど、右前肢に偏って使用していたことを意味する。行動試験は、血栓を生じる前、1日後、2日後、4日後と繰り返し行った。白抜き四角は、無処置のマウス群(8匹)、紫の菱形は、アドレナリン受容体の阻害薬を事前に投与した群(8匹)である。*は統計的に有意な差が得られたことを意味する。アドレナリン受容体阻害薬を事前投与した群では、左右の前肢の使用頻度に差が見られなかった。実線は平均値、影は標準誤差を示す。
次に、脳梗塞に伴う脳内の水の動きの変化を詳しく調べるために、主にアストロサイトに発現するアクアポリン4のみを蛍光物質で標識する手法(免疫組織化学染色法)を用いて、脳内のアクアポリン4の分布を可視化しました。その結果、脳梗塞3時間後では、損傷部位でアクアポリン4の標識が約6割減少していました。一方、アストロサイトにだけ発現している別のタンパク質(GLAST)の発現には変化が見られませんでした(図3上)。このことは、アクアポリン4の減少が細胞死によるものではないことを示唆しています。一方、アドレナリン受容体の阻害薬を事前に投与すると、アクアポリン4の標識が維持されることを見いだしました(図3下)。
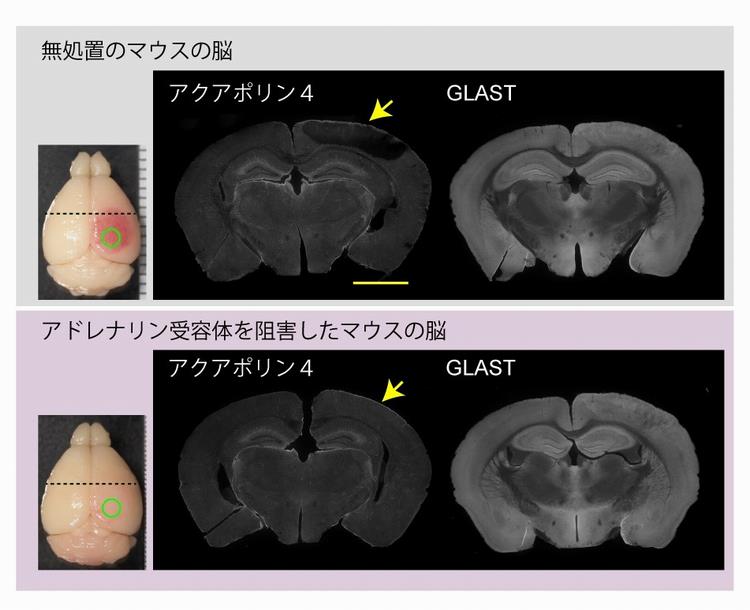
図3脳梗塞3時間後のアクアポリン4分布の可視化
緑の円の部分にレーザーを照射して脳梗塞を引き起こし、3時間後に脳のアクアポリン4とGLAST(グルタミン酸トランスポーターの一種)の分布を免疫組織染色法により可視化した。左図の点線の位置の冠状断切片の例を示す。スケールバーは1 mm。
(上)無処置のマウスの脳。黄色矢印で示した部位は、対側と比べてアクアポリン4の標識が減少していることが分かる。一方で、GLASTには変化がない。
(下)アドレナリン受容体の阻害薬を事前に投与したマウスの脳。黄色矢印で示した部位には、アクアポリン4の標識が維持されており、GLASTにも変化がない。
さらに、アクアポリン4を欠損した遺伝子改変マウスでは、アドレナリン受容体の阻害薬による神経保護効果は得られませんでした。また、アドレナリン受容体の阻害薬を事前に投与した後に、脳梗塞を起こし、さらに1時間後に薬を用いてアクアポリン4の機能を一時的に阻害しても、アドレナリン受容体の阻害薬の効果が得られないことを見いだしました。これらの結果は、アドレナリン受容体の阻害による神経保護効果に、アクアポリン4の機能が重要な役割を果たしていることを示しています。
イオン選択性微小電極を用いて、大脳皮質細胞外のK+濃度を直接測定した結果、脳梗塞直後から3時間後にわたって通常の4~5倍の高い水準のK+が検出されました。一方、アドレナリン受容体の阻害薬を事前に投与した場合は、約60分後に正常な水準に戻っていました。また、アクアポリン4を欠損した遺伝子改変マウスではアドレナリン受容体の阻害薬を事前に投与したとしても、K+濃度は高いままでした(図4A)。
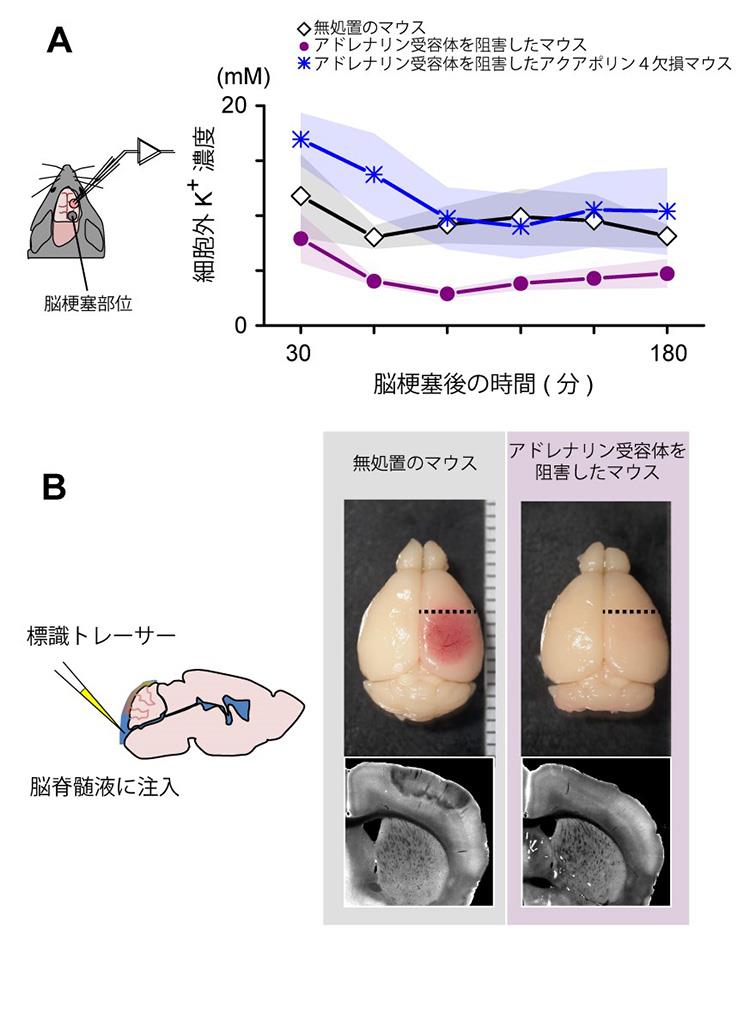
図4 脳梗塞後のカリウムイオン濃度の定量と脳脊髄液浸潤の可視化
(A)イオン選択性微小電極を用いて、脳組織液K+濃度を測定した。脳梗塞直後から3時間後まで30分ごとの平均値を図に示した。縦軸はイオンの濃度を表すmM [ミリモーラー](ミリは1000分の1)。白抜きひし形は、無処置のマウス群(5匹)、紫の丸は、アドレナリン受容体の阻害薬を事前に投与した群(5匹)、青い米印はアクアポリン4欠損マウスにアドレナリン受容体の阻害薬を事前に投与した群(5匹)の結果である。アドレナリン受容体を阻害したマウスでは、約60分後にK+濃度は正常な水準に戻った。実線は平均値、影は標準誤差を示す。
(B)脳脊髄液中にトレーサーを注入し脳組織内に浸潤した脳脊髄液を標識した。注入30分後、図の点線の位置で冠状断(脳を前後に分ける面)で輪切りにした脳スライスを用いて、トレーサーに蛍光標識して空間分布を可視化した。無処理のマウスでは脳脊髄液の浸潤が少なくなったのに対し、アドレナリン受容体を阻害したマウスでは正常に浸潤したことが分かった。
以上の結果から、国際共同研究グループは、「アドレナリン受容体の阻害によってアクアポリン4の局在が確保され、脳脊髄液の移動によって、K+濃度を正常化し、神経保護と脳機能回復を促進する」という排出(クリアランス)のモデルを提案しました(図5)。

図5 アドレナリン受容体の阻害によってカリウムイオンを正常化するクリアランスのモデル
A)ノルアドレナリンの作用により、グリア細胞のアストロサイトが活性化し、細胞内カルシウムイオン(Ca2+)が上昇する。それに伴い、アストロサイトの足突起に局在する水の通り道であるアクアポリン4が減少する。その結果、高濃度のK+を含む水が脳組織に滞留し、長期間にわたり神経細胞(ニューロン)の活動を抑制する。
B)アドレナリン受容体を阻害することにより、アクアポリン4の局在が確保される。水の動きによってK+が排出(クリアランス)され、神経保護や脳機能回復が促進される。
3.今後の期待
本研究成果は、さまざまな脳血管障害に共通して生じる組織損傷のメカニズムの解明に貢献すると考えられます。さらに本研究成果は将来的に、細胞外K+濃度の正常化を標的とした脳梗塞の早期対処法を開発するための橋渡しとなることが期待できます。
4.論文情報
<タイトル>
Adrenergic receptor antagonism induces neuroprotection and facilitates recovery from acute ischemic stroke
<著者名>
Hiromu Monai, Xiowen Wang, Kazuko Yahagi, Nanhong Lou, Humberto Mestre, Qiwu Xu, Yoichiro Abe, Masato Yasui, Youichi Iwai, Maiken Nedergaard, Hajime Hirase
<雑誌>
Proceedings of the National Academy of Sciences (PNAS)
<DOI>
10.1073/pnas.1817347116
https://doi.org/10.1073/pnas.1817347116
5.補足説明
[1] 虚血
血栓や出血などにより血液の循環が滞り、臓器への血液供給が途絶える状態。
[2] 脳卒中、脳梗塞
脳卒中とは、脳血液循環に出血や血管障害などにより脳組織が損傷し、運動障害、言語障害、意識障害など生じる発作である。血栓性の脳卒中を脳梗塞と呼ぶ。
[3] ノルアドレナリン
神経伝達物質の一種で、脳幹の青斑核でチロシンから合成される。青斑核ニューロンは大脳皮質を含む脳組織に広く投射し、ノルアドレナリンの拡散性伝達を行う。脳のアドレナリン受容体は、ノルアドレナリンにより活性化され、注意や覚醒などに影響する。ノルエピネフリンとしても知られる。
[4] アクアポリン4
水分子を選択的に透過させるアクアポリンの一種である。アクアポリン4は脳の主要な水チャネル分子であり、脳で顕著な発現が認められる。アストロサイトでの発現は、血管を被覆する部位(終足)で特に高い発現を示し、4量体が規則正しく集積した特殊な構造を作ることが知られている。
[5] アストロサイト
脳を構成するグリア細胞の一種。血管と直接の相互作用を持ち、ニューロンへのエネルギー供給や脳内環境の恒常性維持を担うことが知られている。
[6] 脳脊髄液、組織液
脳脊髄液は、頭蓋内を満たし、脳を保護している無色透明な液体。脳内で血液から産生され、イオン組成が一定に保たれている。脳脊髄液が脳内に浸潤し、細胞外液となったものを組織液(あるいは間質液)と呼ぶ。
[7] 光血栓法
ローズベンガル色素を血中に導入した状態で、緑色光を照射することにより血栓を生じさせ、局所的な脳梗塞を誘導する方法。
6.発表者・機関窓口
<発表者> ※研究内容については発表者にお問い合わせ下さい
お茶の水女子大学 基幹研究院自然科学系
助教 毛内 拡(もうない ひろむ)
(理化学研究所 脳神経科学研究センター 神経グリア回路研究チーム 客員研究員)
研究室HP https://www-p.sci.ocha.ac.jp/bio-monai-lab/
理化学研究所 脳神経科学研究センター 神経グリア回路研究チーム
チームリーダー 平瀬 肇(ひらせ はじめ)
(University of Copenhagen Center for Translational Neuromedicine, 教授)
慶應義塾大学 医学部
教授 安井 正人(やすい まさと)
<機関窓口>
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press[at]riken.jp
お茶の水女子大学 企画戦略課(広報担当)
TEL:03-5978-5105 FAX:03-5978-5545
E-mail:info[at]cc.ocha.ac.jp
慶應義塾大学信濃町キャンパス 総務課
TEL:03-5363-3611 FAX:03-5363-3612
E-mail:med-koho[at]adst.keio.ac.jp
※上記の[at]は@に置き換えてください。
――――――――――――――――――――――――――――――――――――――










